LENGUAJE DE
LA QUÍMICA
En QUÍMICA se utiliza un lenguaje especial a base de
símbolos, símbolos químicos, fórmulas químicas, ecuaciones químicas y signos
comunes.
Para poder describir los compuestos químicos y las
reacciones que se dan entre ellos de forma precisa y sencilla, la comunidad
científica vio necesario adoptar un lenguaje cómodo, fácil de entender y común
para todos.
El lenguaje de la química es universal este es a saber los
diferentes símbolos usados para representar los elementos por ejemplo: hierro
Fe, plata Ag, Carbono C . azufre S los elementos se representan con dos o una
letra cuando son dos ,la primera es mayúscula la segunda minúscula. ...si es solo
una letra esta sera en mayúscula. la unión de dos o mas elementos forman
compuestos que se representan a saber de la siguiente manera. por ejmplo H2O =
agua ,,
NaCl = cloruro de sodio HCl(g) = cloruro de hidrógeno y así
por el estilo otra parte del lenguaje son las reprersentaciones de las
reacciones químicas por eje. H2 + O2 produce H2O
Na + Cl produce NaCl. ...Las ecuaciones están
desbalanceadas. y en lugar de escribir produce se dibuja una flecha. Sin mucho
bla,bla es el lenguaje de la química.
LOS SIMBOLOS Y LAS FORMULAS QUIMICAS A TRAVEZ D ELA
HISTORIA
El desarrollo de la química como ciencia hizo necesario dar
a cada sustancia desconocida necesario dar a cada sustancia conocida un nombre
que pudiera representarse de forma abreviada, pero que al mismo tiempo
incluyera información acerca de la composición molecular de las sustancias y de
su naturaleza elemental.
Los alquimistas habían empleado ya símbolos para representar
los elementos y compuestos hasta entonces conocidos. Muchos de estos símbolos y
formulas representaban cuerpos celestes, pues, los primeros químicos pensaban
que las sustancias materiales estaban íntimamente relacionadas con el cosmos.
Dalton fue el primero en utilizar un sistema de signos, desprovisto de
misticismo, para los diferentes elementos y con base en estos, para algunos
compuestos.
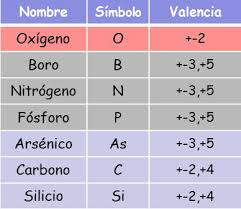
Los símbolos modernos para representar los elementos
químicos se deben a Berzelius, quien propuso utilizar, en vez de signos
arbitrarios, la primera letra del nombre latino del elemento. Cuando varios
elementos tuvieran la misma inicial, se representaban añadiendo la segunda
letra del nombre. Así, por ejemplo, el carbono, el cobre y el calcio se
representan: C, Cu y Ca, respectivamente. Observa que la primera letra se
escribe en mayúscula, mientras que la segunda, cuando esta presente, se escribe
en minúscula.
De la misma manera como estos símbolos representan
elementos, las formulas indican la composición molecular de las sustancias,
mediante la yuxtaposición de los símbolos de los elementos constituyentes. Para
indicar el número de átomos presentes de cada elemento integrante de la
molécula, se escribe tal cantidad como un subíndice al lado del correspondiente
elemento. Por ejemplo, la fórmula del agua H2O, indica que esta constituida por
dos átomos de hidrógeno y uno de oxígeno.
El desarrollo de la química como ciencia hizo necesario dar
a cada sustancia conocida un nombre que pusiera representarse de forma
abreviada, pero que al mismo tiempo incluyera información acerca de la composición
molecular de las sustancias y de su naturaleza elemental.
NOMENCLATURA QUIMICA
La nomenclatura es un conjunto de normas que indican el
nombre que deben llevar las formulas de las moléculas y permiten su
identificación. Los compuestos tienen un nombre y una estructura
especifica.
La IUPAC recomienda prescindir del sistema tradicional e ir
adoptando en forma progresiva la nomenclatura sistemática moderna. Este cambio
tiene que ser gradual porque de lo contrario ocasionaría un caos en las grandes
recopilaciones existentes, especialmente en la industria farmacéutica y en los
textos científicos y pedagógicos. La nomenclatura sistemática moderna se
basa en el modelo de Alfred Stock en el cual, si un elemento presenta dos o mas
números de oxidación, los nombres de los compuestos formados por el se
asignaran mediante el sistema de Para poder describir los compuestos químicos y
las reacciones que se dan entre ellos de forma precisa y sencilla, la comunidad
científica vio necesario adoptar un lenguaje cómodo, fácil de entender y común
para todos.
Para empezar, cada elemento debía representarse con un
símbolo diferente, ya que son las piezas básicas de las sustancias químicas:
combinándolos sirven para representar cualquier sustancia de forma inequívoca.
En la antigüedad, los símbolos eran identificados con los
siete planetas conocidos, ya que química y alquimia eran lo mismo y estaban muy
relacionadas con la astrología. Dalton, el creador de la teoría atómica,
propuso usar la inicial del nombre del elemento y representar los elementos en
distintos círculos para mostrar las moléculas de cada compuesto mediante el
número necesario de círculos. Muy poco después, Berzelius suprimió los
círculos, quedándose sólo con la inicial del nombre latino de cada elemento...
Si la inicial de dos elementos coincidía, se añadía al símbolo alguna de las
letras siguientes.
Una vez aceptada la forma de llamar a los elementos
químicos, podía desarrollarse la estructura de las fórmulas químicas de los
compuestos, o lo que es lo mismo, cómo representar la composición de un
compuesto o cómo explicar los distintos átomos que forman sus moléculas.
Para ello, se indican los elementos que forman el compuesto,
mediante sus símbolos. Si hay más de un átomo de un elemento, se indica con
subíndice: por ejemplo, la fórmula más conocida, H2O, explica que la molécula
del agua está compuesta por dos átomos de hidrógeno y uno de oxígeno.
Símbolos y fórmulas
El desenvolvimiento de la Química como ciencia hacía
necesario el dar a cada cuerpo conocido un nombre que fuese expresión de, su
naturaleza química y a representarlo en una forma abreviada que respondiese a
su composición molecular. De esta manera, la representación de las reacciones
químicas daría idea inmediata en cada caso de la naturaleza íntima de la
transformación correspondiente. Para ello, era preciso establecer previamente
un símbolo para los átomos de los elementos que fuese a su vez expresión inmediata
de su nombre.
Los alquimistas habían ya empleado símbolos para representar
los elementos entonces conocidos así como para distintos compuestos y formas de
energía, algunos de los cuales se reproducen en la figura pero dichos símbolos
eran completamente artificiosos, y así, para los metales, eran idénticos a los
de los astros a los que aquellos se imaginaban íntimamente relacionados. La
voísíer propuso algunos signos convencionales para representar distintas
substancias, pero fué DALTON el primero en utilizar signos diferentes para los
átomos de los elementos entonces conocidos o supuestos, y mediante la
combinación de ellos pudo representar la constitución de muchos compuestos a
partir de la composición elemental encontrada para los mismos números
romanos.

.jpg)
